Pe 5 iulie, Novo Nordisk a lansat în China un studiu clinic de fază III al injectării CagriSema, al cărui scop este să compare siguranța și eficacitatea injectării CagriSema cu semeglutidă la pacienții obezi și supraponderali din China.
Injectarea CagriSema este o terapie combinată cu acțiune lungă în curs de dezvoltare de către Novo Nordisk, componentele principale sunt smeglutida agonist al receptorului GLP-1 (peptidă asemănătoare glucagonului-1) și un analog al amilinei cagrilintidă cu acțiune lungă.CagriSema injectabil poate fi administrat subcutanat o dată pe săptămână.
Obiectivul principal a fost compararea CagriSema (2,4 mg/2,4 mg) cu semeglutidă sau placebo o dată pe săptămână pe cale subcutanată.Novo Nordisk a anunțat rezultatele unui studiu CagriSema pentru tratamentul diabetului zaharat în stadiul 2, care a demonstrat că efectul hipoglicemiant al CagriSema este mai bun decât cel al semeglutidei și aproape 90% dintre subiecți au atins obiectivul HbA1c.
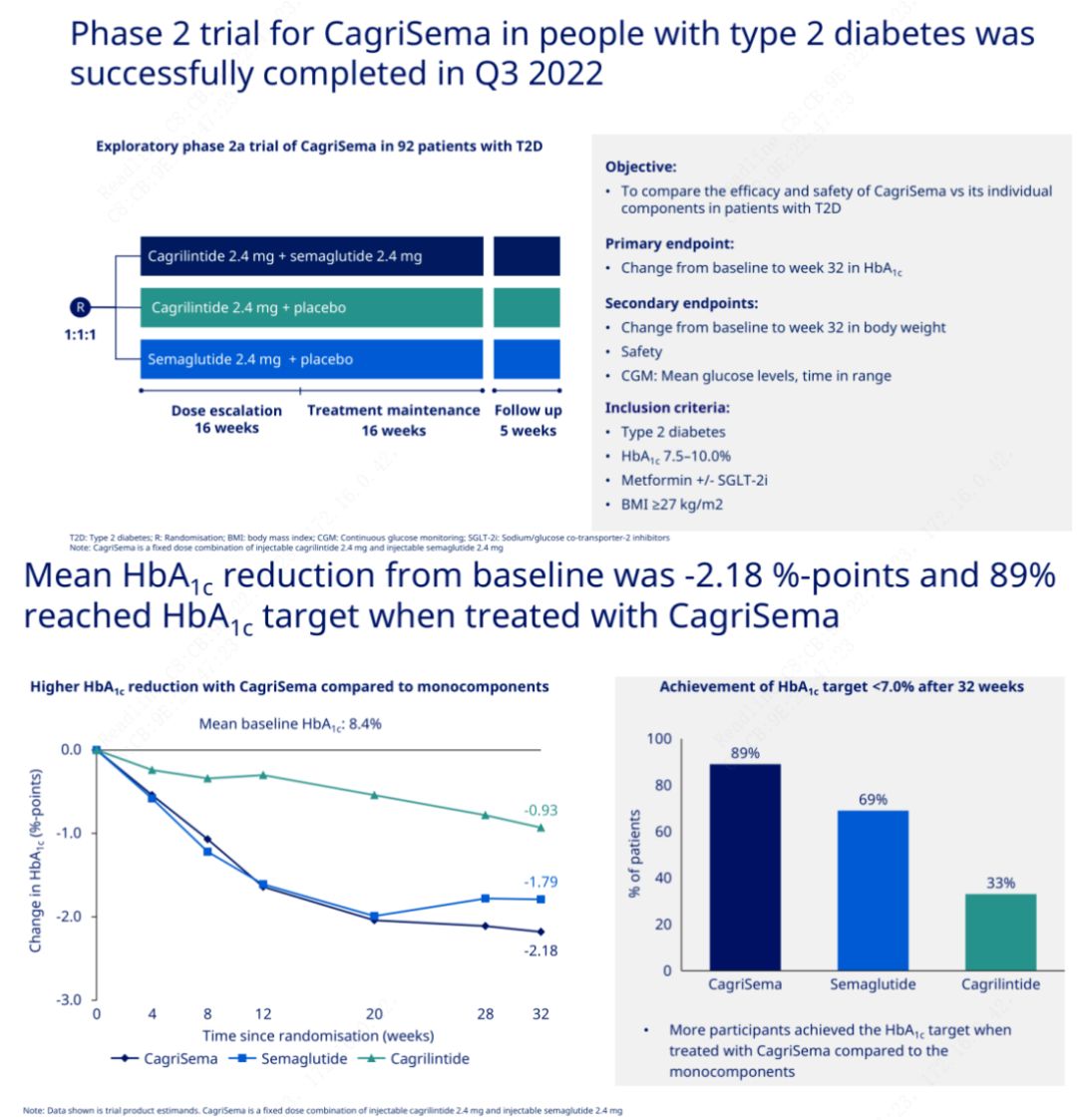
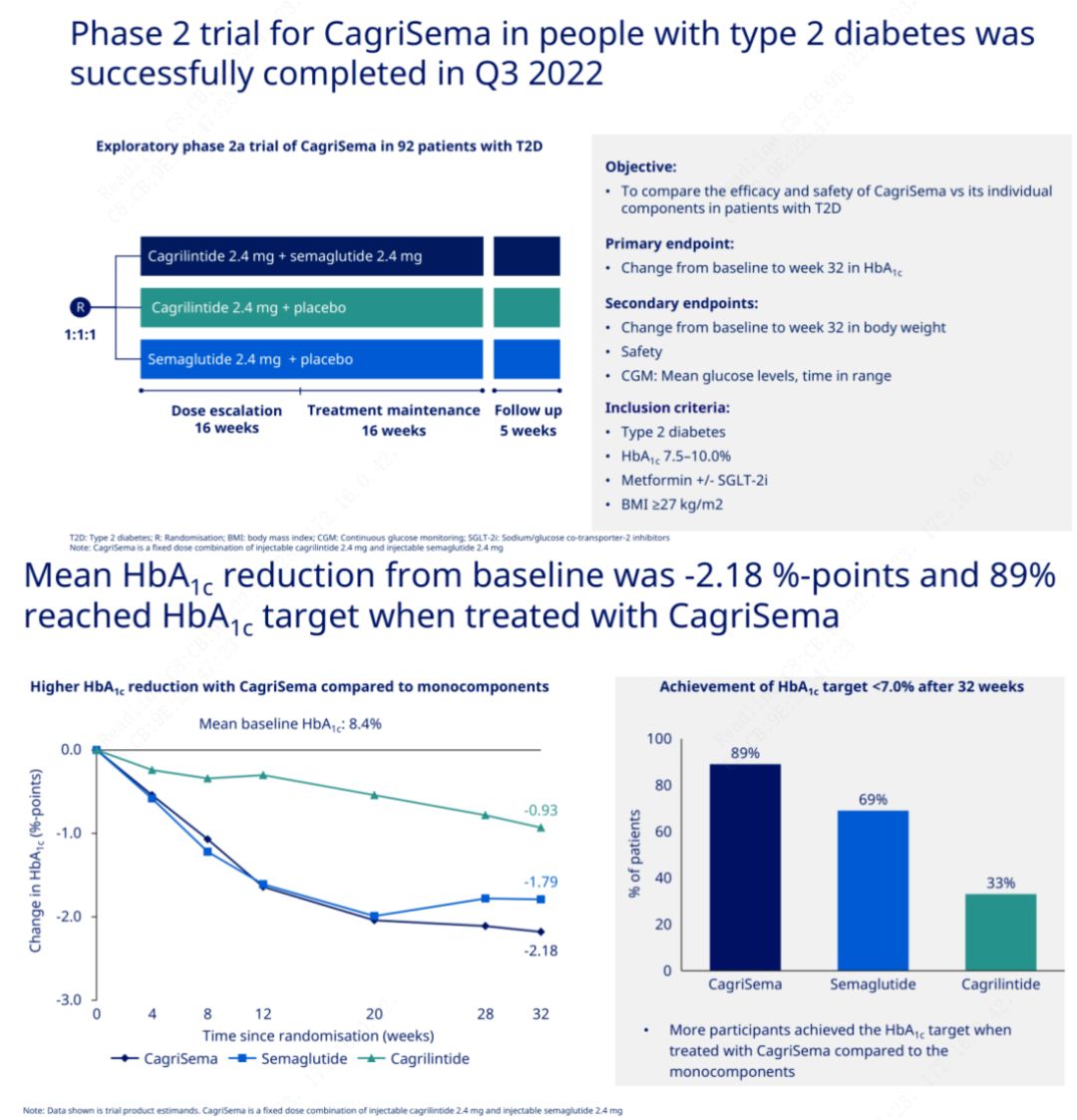
Datele au arătat că, pe lângă efectul hipoglicemic semnificativ, în ceea ce privește pierderea în greutate, injecția CagriSema a depășit semnificativ semeglutida (5,1%) și cagrilintid (8,1%) cu o scădere în greutate de 15,6%.
Medicamentul inovator Tirzepatide este primul agonist săptămânal al receptorului GIP/GLP-1 aprobat din lume.Combină efectele a două incretine într-o singură moleculă care este injectată o dată pe săptămână și reprezintă o nouă clasă de tratamente pentru diabetul de tip 2.Tirzepatida a fost aprobată de Administrația SUA pentru Alimente și Medicamente (FDA) în mai 2022 pentru a îmbunătăți controlul glicemic (pe bază de dietă și exerciții fizice) la adulții cu diabet zaharat de tip 2 și este în prezent aprobată în Uniunea Europeană, Japonia și alte țări.
Pe 5 iulie, Eli Lilly a anunțat un studiu de fază III SURPASS-CN-MONO privind înregistrarea studiilor clinice de medicamente și platforma de dezvăluire a informațiilor pentru tratamentul pacienților cu diabet de tip 2.SURPASS-CN-MONO este un studiu de fază III randomizat, dublu-orb, controlat cu placebo, conceput pentru a evalua eficacitatea și siguranța monoterapiei cu tirzepatidă în comparație cu placebo la persoanele cu diabet zaharat de tip 2.Studiul a planificat să includă 200 de pacienți cu diabet zaharat de tip 2 care nu luau niciun medicament antidiabetic în cele 90 de zile premergătoare vizitei 1 (cu excepția anumitor situații clinice, cum ar fi boală acută, spitalizare sau intervenție chirurgicală electivă, pe termen scurt (≤14). zile) utilizarea insulinei).
Diabetul de tip 2 este de așteptat să fie aprobat în acest an
Luna trecută, rezultatele unui studiu SURPASS-AP-Combo au fost publicate pe 25 mai în revista de succes Nature Medicine.Rezultatele au arătat că, în comparație cu insulina glargin, Tirzepatide a prezentat o HbA1c mai bună și o reducere a greutății la populația de pacienți cu diabet de tip 2 din regiunea Asia-Pacific (în principal China): reducerea HbA1c de până la 2,49% și reducerea greutății de până la 7,2 kg. (9,4%) la 40 de săptămâni de tratament, îmbunătățirea semnificativă a lipidelor din sânge și a tensiunii arteriale și siguranța și tolerabilitatea generale au fost bune.
Studiul clinic de fază 3 al SURPASS-AP-Combo este primul studiu al Tirzepatidei efectuat în principal pe pacienți chinezi cu diabet zaharat de tip 2, condus de profesorul Ji Linong de la Spitalul Popular al Universității din Peking.SURPASS-AP-Combo este în concordanță cu rezultatele serii globale de cercetări SURPASS, care demonstrează în continuare că patofiziologia diabetului zaharat la pacienții chinezi este în concordanță cu cea a pacienților la nivel mondial, care stă la baza cercetării și dezvoltării simultane de noi medicamente. în China și în lume și oferă, de asemenea, dovezi solide pentru a oferi pacienților chinezi oportunitatea de a utiliza cele mai recente medicamente pentru tratamentul diabetului și aplicarea lor clinică în China cât mai curând posibil.
Ora postării: 18-sept-2023

